Research

リガクル 「世界を変える分子を創り出す」Sept. 9, 2022
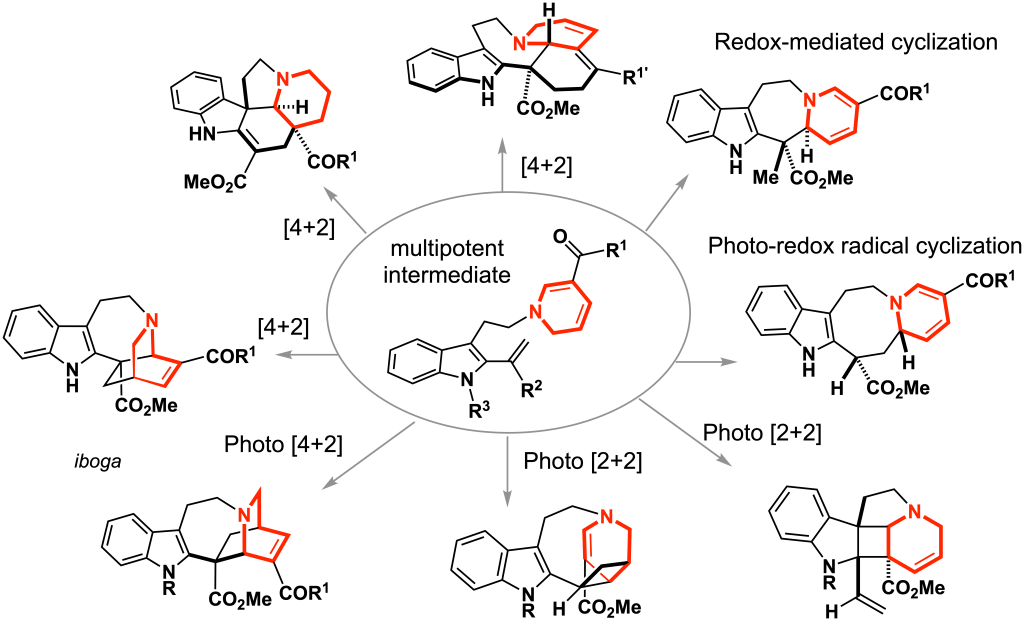
多様な骨格を系統的に合成する:骨格多様化合成 (ref. 1–5)
機能性物質の創製を原子・分子スケールから革新していく基盤技術として、分子骨格レベルで三次元構造を多様化する合成化学の重要性が認識されるようになりました。我々は多種多様な二次代謝産物を創出する生合成経路を摸倣しながら、合成化学的に改変・拡張するアプローチに取り組んできました。仮想生合成中間体を安定化した多能性中間体を設計し,5種類のインドールアルカロイド骨格の作り分けを実現しました。複雑なアルカロイドの構造を簡略化することなく,多官能性の化合物群を僅か6-9工程で合成できます。分子骨格・立体化学や官能基を系統的に多様化しながら、アセンブリーライン合成するための戦略の提案と体系化に取り組んでいます。
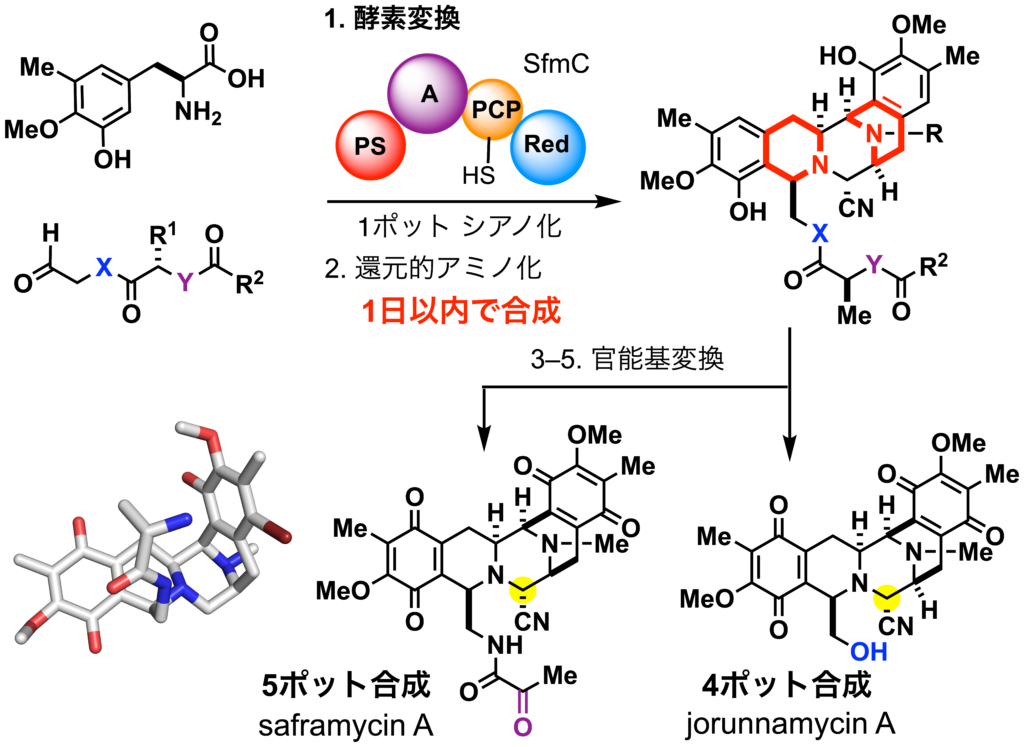
生合成プロセスの合理的改変:化学−酵素ハイブリッド合成 (ref. 6–7)
植物や微生物は、酵素マシナリーを利用して生物活性天然物群をいとも簡単に生理的条件下で作り上げます。 これら酵素の反応を合成化学で活用できれば、医薬品候補分子群を格段にたやすく合成できるはずです。我々は、酵素合成と化学合成を連携させ、シンプルな基質から複雑な五環性骨格をわずか1日で合成できる化学−酵素ハイブリッドプロセスを開発しました。更に、微生物が本来利用している基質に類似した合成基質群を設計し、生合成では産生されていない分子群の合成にも成功しました。酵素反応と有機合成反応をシームレスに融合させ、官能基を改変した天然物類似化合物群を手早く柔軟に合成できます。
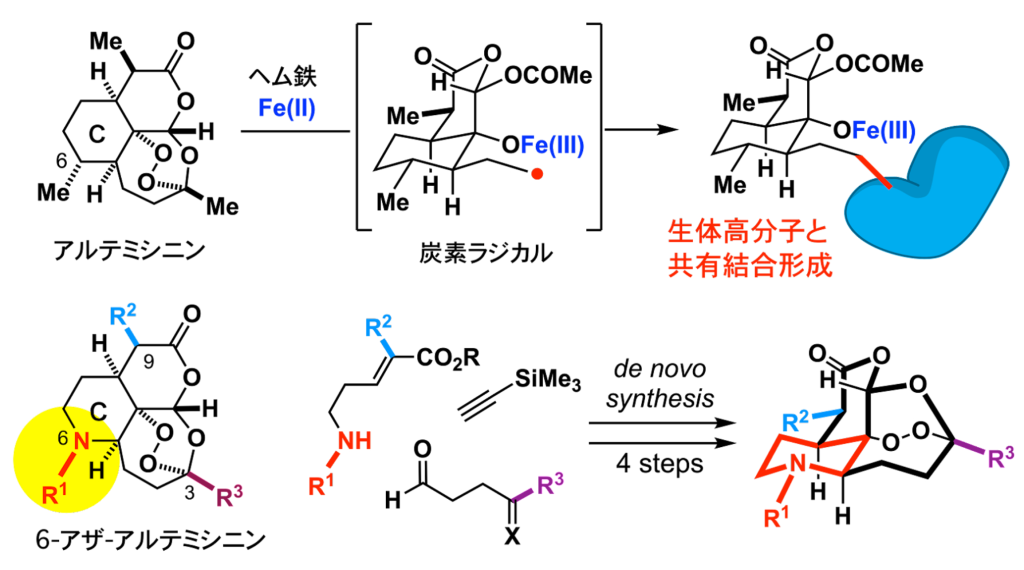
共有結合性リガンド群を活用したケミカルバイオロジー研究 (ref. 8–9)
漢方薬の有効成分であるアルテミシニンやその誘導体は、マラリア治療に革新をもたらしました。細胞内のヘム鉄とペルオキシド架橋部位との反応で生じる炭素ラジカル種が生体分子と共有結合を形成しつつ,局所的な酸化ストレスを亢進します。我々は、アルテミシニン類の6位の炭素を窒素に置き換えた分子群を設計し、単純な構築ブロックからわずか4工程で四環性骨格を構築しました。これにより、従来構造改変が困難であった C 環部へ様々な置換基を導入した類縁体群を創出しました。合成法の改良や構造の多様化を進めるとともに、分子プローブを活用したケミカルバイオロジー研究や創薬リード創製に取り組んでいます。
天然物骨格を活用した超分子形成・機能創発 (ref. 10)
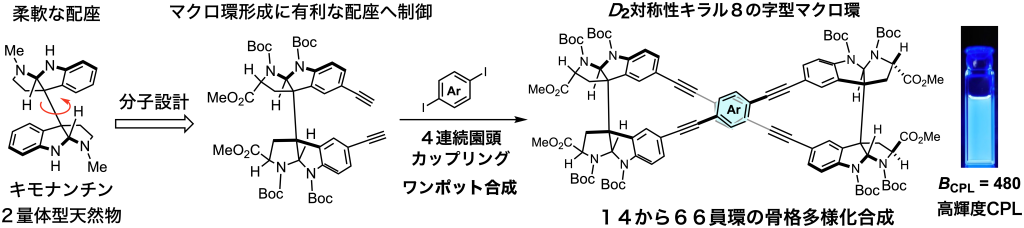
生物活性天然物は、一般に複数のsp3不斉炭素を有し、多様な官能基群が密に集積化された構造特性を持ちます。我々は、高度に官能化された天然物の構造に潜在する精緻な分子認識能力に着目し、機能性ナノ構造体を組み上げていくアプローチに着手しました。キラルな C2 対称型アルカロイド骨格の立体化学を改変し、点不斉情報に依存して発光性錯体形成様式/キロプティカル特性/ナノ粒子サイズ制御を実現しています。天然物骨格を基盤として、機能性ユニット間の空間配置を系統的に多様化できる多官能性スキャフォールド群を創製しています。天然物類似中分子群を基盤として超分子を形成させ、センシング機能を創発するシステムを開発していきます。
References
- Biogenetically inspired synthesis and skeletal diversification of indole alkaloids. H. Mizoguchi, H. Oikawa, H. Oguri. Nat. Chem. 2014, 6, 57–64.
- Zn(OTf)2-mediated annulations of N-propargylated tetrahydrocarbolines: divergent synthesis of four distinct alkaloidal scaffolds. S. Yorimoto, A. Tsubouchi, H. Mizoguchi, H. Oikawa, Y. Tsunekawa, T. Ichino, S. Maeda, H. Oguri. Chem. Sci. 2019, 10, 5686–5698.
- Synthesis of a Halicyclamine-type Macrocyclic Scaffold via Biomimetic Transannular Cyclization. T. Wayama, H. Oguri. Org. Lett. 2023, 25, 3596–3601.
- Synthetic Modulation of an Unstable Dehydrosecodine-type Intermediate and Its Encapsulation into a Confined Cavity Enable Its X-ray Crystallographic Observation. G. Tay, T. Wayama, H. Takezawa, S. Yoshida, S. Sato, M. Fujita, H. Oguri. Angew. Chem. Int. Ed. 2023, 62, e202305122.
- Direct photochemical intramolecular [4 + 2] cycloadditions of dehydrosecodine-type substrates for the synthesis of the iboga-type scaffold and divergent [2 + 2] cycloadditions employing micro-flow system. G. Tay, S. Nishimura, H. Oguri Chem. Sci. 2024, 15, 15599–15609 (Edge Article).
- Chemo-enzymatic Total Syntheses of Jorunnamycin A, Saframycin A, and N-Fmoc Saframycin Y3. R. Tanifuji, K. Koketsu, M. Takakura, R. Asano, A. Minami, H. Oikawa, H. Oguri. J. Am. Chem. Soc. 2018, 140, 10705–10709.
- Chemo-enzymatic total syntheses of bis-tetrahydroisoquinoline alkaloids and systematic exploration of the substrate scope of SfmC. R. Tanifuji, N. Haraguchi, H. Oguri, Tetrahedron Chem. 2022, 1, 100010.
- Rapid and Systematic Exploration of Chemical Space Relevant to Artemisinins: Anti-malarial Activities of Skeletally Diversified Tetracyclic Peroxides and 6-Aza-artemisinins. J. Org. Chem. 2020, 85, 9694–9712.
- Synthesis and Structural Diversification of Artemisinins Towards the Generation of Potent Anti-malarial Agents H. Oguri. Chem. Lett. 2021, 50, 924–937 (highlighted review).
- Rapid Synthesis of Chiral Figure-Eight Macrocycles Using a Preorganized Natural Product-Based Scaffold. T. Honda, D. Ogata, M. Tsurui, S. Yoshida, S. Sato, T. Muraoka,. Y. Kitagawa, Y. Hasegawa, J. Yuasa, H. Oguri Angew. Chem. Int. Ed. 2024, e202318548.


